|
|
撰写:花博 来源:小张聊科研平台的“ 课题指南针”公众号,微信公众号搜索“ 课题指南针”即可关注/扫描关注见文末
#国自然# #科研热点# #课题思路# #代谢重编程# #乳酸化修饰#
大家好,上个星期花博介绍了近几年非常火的表型热点——代谢重编程,相信很多小伙伴都已经开始着手设计代谢重编程方向的国自然和课题了。然而有一些小伙伴会问:我们的课题在确定了细胞表型之后,机制又应该怎样选择呢?如何能够使机制既和表型有较强的相关性,又能具有一定的创新性?
这里就要向大家推荐与代谢重编程表型高度适配的机制热点之一——蛋白乳酸化修饰。
说到蛋白乳酸化修饰,顾名思义,就是蛋白质的氨基酸残基位点(如赖氨酸)修饰了以乳酸为来源底物的酰化修饰,最早由芝加哥大学赵英明教授课题组发现,该研究发现代谢过程中积累的乳酸可以作为前体物质导致组蛋白赖氨酸发生乳酸化修饰,并参与细菌感染的M1巨噬细胞的稳态调控。相关工作于2019年发表在《Nature》正刊上[1]。由于乳酸是Warburg效应中糖酵解的主要产物(别再只会“Warburg效应”啦,这些也是代谢重编程的热点方向),而乳酸化修饰的关键“原料”就是乳酸,因此乳酸化修饰一经发现就受到广泛关注,成为重要的科研热点。
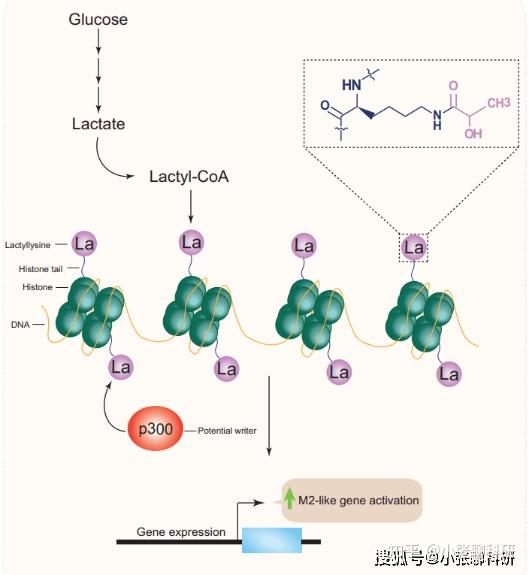
组蛋白乳酸化修饰机制示意图[2]
今年是乳酸化修饰发现的第三个年头,该领域的研究又有了哪些进展?
让我们来看看这篇今年发表于《Signal Transduction and Targeted Therapy》(IF=38.104),题为“Lactate metabolism in human health and disease”的综述是怎么说的[3]。
01
乳酸的功能
乳酸在一开始被认为是无氧代谢的无用产物,但随着研究的深入,越来越多的研究将其视作信号分子。通过转运蛋白MCTs家族和受体GPR81,乳酸得以调控生理和病理过程,激活细胞内下游能量代谢、脂肪分解、神经保护、炎症调节等通路。乳酸在组织微环境中的积累已成为炎性和肿瘤疾病的特征之一。
在细胞内,乳酸除了由转运蛋白负责进出外,其来源有两种:糖酵解和谷氨酰胺代谢(图1)。一方面,乳酸可以转化为丙酮酸进入三羧酸(TCA)循环,另一方面,乳酸生成乳酰辅酶A(Lactyl-CoA)参与组蛋白和非组蛋白的乳酸化修饰。
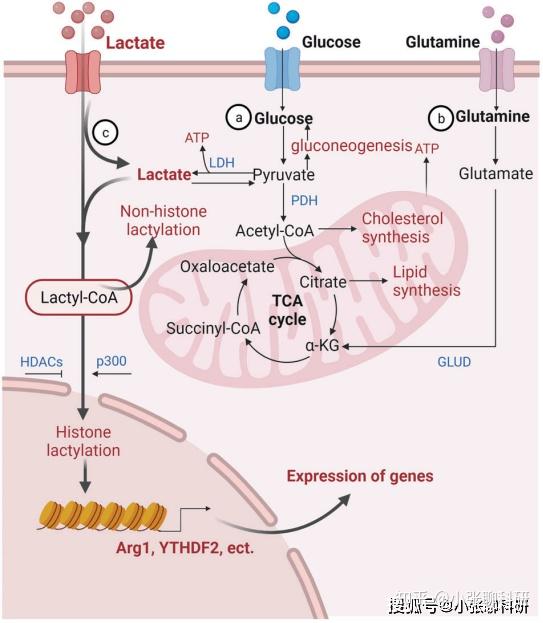
图1 细胞内的乳酸代谢和蛋白乳酸化
乳酸参与多种生物学过程(图2),具体如下:
1)能量调节:乳酸对能量产生至关重要,能根据外源性和内源性乳酸的积累水平调节能量,通过产物反馈途径抑制糖酵解。此外,乳酸可以激活多种细胞内质网(ER)中Mg2+的释放,这种Mg2+的转运机制与主要代谢反馈环路和线粒体生物能功能有关,以促进线粒体Mg2+的产生。
2)氧化还原缓冲:乳酸作为氧化还原缓冲物,对氧化状态有很大贡献。然而,当氧化辅酶和还原性辅酶的比例不平衡时,乳酸会通过调节其他形式的能量代谢来稳定细胞的氧化还原状态。
3)脂肪酸代谢调控:乳酸可以调控脂肪酸代谢中的关键步骤β氧化。在炎症应激反应中,脂肪酸氧化产生的乙酰辅酶A可通过非酶乙酰化促进糖酵解,促进乳酸的形成。
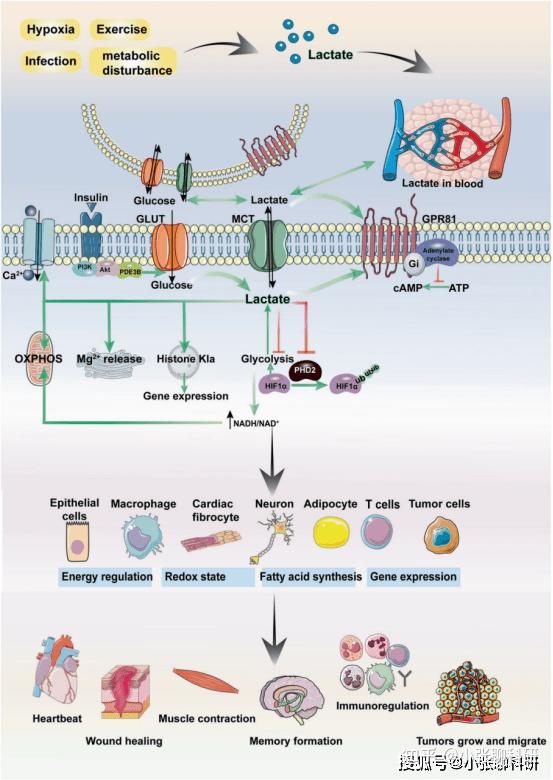
图2 乳酸参与细胞生理和病理过程的调控
02
乳酸穿梭(Lactate shuttle)
乳酸穿梭描述的是乳酸在细胞内和细胞间的穿梭,是乳酸跨膜迁移整个过程的概括。
细胞内乳酸穿梭:Hashimoto等人总结了以下6点来支持细胞内乳酸穿梭理论。
1.用电镜和激光扫描共聚焦显微镜在大鼠和人的心肌、肝脏和骨骼肌线粒体中检测到LDH;
2.这些分析的结果表明线粒体在大鼠和人类的骨骼肌和心肌中与MCT1共定位;
3.LDH和MCT1及其分子伴侣CD147已在从大鼠和人骨骼肌、心肌、肝脏和肾脏分离的线粒体中发现;
4.生理实验数据表明,线粒体氧化乳酸的速度比丙酮酸快;
5.同位素示踪和核磁共振成像(MRI)表明,人类和其他哺乳动物的心肌和骨骼肌细胞线粒体可以氧化乳酸;
6.线粒体蛋白质组学研究结果支持乳酸穿梭假说。
尽管在一些证据上还存在争议,但乳酸在线粒体内的功能已被广泛证明。
细胞间乳酸穿梭:细胞间乳酸穿梭的概念于1985年被提出和系统解释。该理论认为,在运动开始时,乳酸迅速产生并在肌肉细胞中积累;然后,其中一些乳酸进入组织,在那里被内化并被邻近的细胞氧化,而其余的乳酸进入血液循环系统,并被运送到心脏、肝脏和肾脏,在这些地方它是氧化能量产生和糖异生的底物。
乳酸穿梭理论适用于多种实践领域,如运动营养和水合作用、酸中毒、创伤性脑损伤的治疗、血糖的维持、炎症的减轻、心力衰竭后的心脏支持、心肌梗死、认知的增强等,而乳酸穿梭的失调则会破坏代谢的灵活性,支持肿瘤的发生。
03
乳酸化修饰
作为2019年才被正式提出的新型组蛋白修饰,尽管乳酸化相关研究近三年才陆续开展,但已显示出巨大的潜力。目前发现的蛋白乳酸化修饰不仅是刚开始发现的组蛋白乳酸化,还包括了其它非组蛋白的乳酸化(图1)。
起初乳酸化研究较多集中于巨噬细胞(发现组蛋白乳酸化的细胞类型)及相关疾病,而由于乳酸的特性,越来越多的研究将目光聚焦于肿瘤中的乳酸化修饰(图3)。目前研究发现组蛋白乳酸化调节肿瘤相关基因如YTHDF2的转录,通过介导下游肿瘤抑制因子的降解促进肿瘤生长、转移和侵袭。组蛋白乳酸化作为一个“实施者”实现了乳酸介导的信号通路激活,支持肿瘤生长。
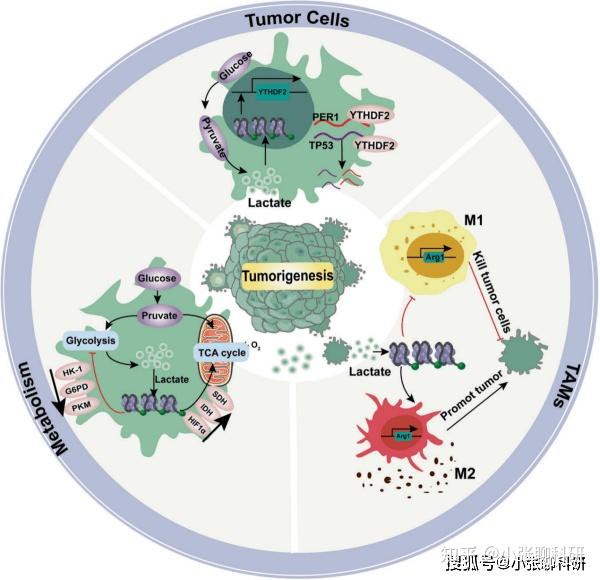
图3 蛋白乳糖化促进肿瘤发生的机制
表1展示的就是不同肿瘤细胞系中已发现的组蛋白乳酸化位点。
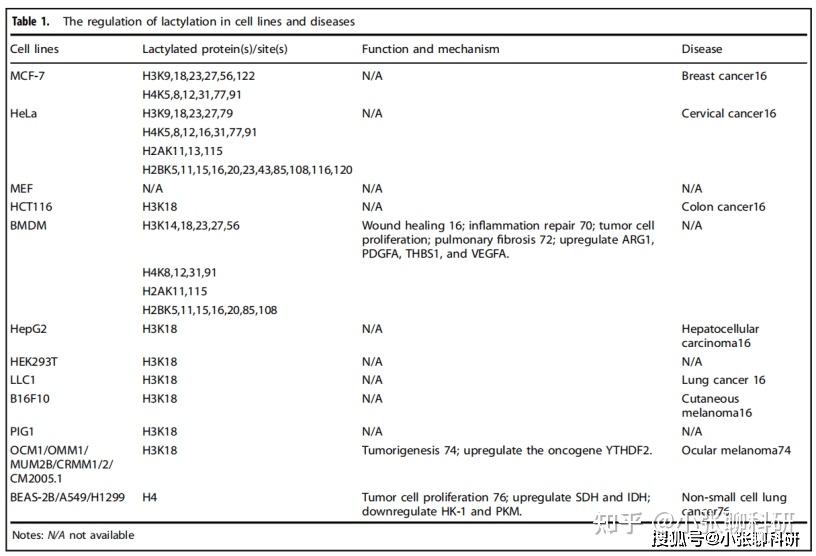
除组蛋白外,已有多项研究发现炎症免疫性疾病中非组蛋白的乳酸化修饰,如脓毒症、系统性红斑狼疮、神经细胞活化等。乳酸化对蛋白具有促进蛋白分泌、转录、酶活性等作用。
04
乳酸与疾病的关系
乳酸在许多疾病中具有广泛的调控功能(图4)。
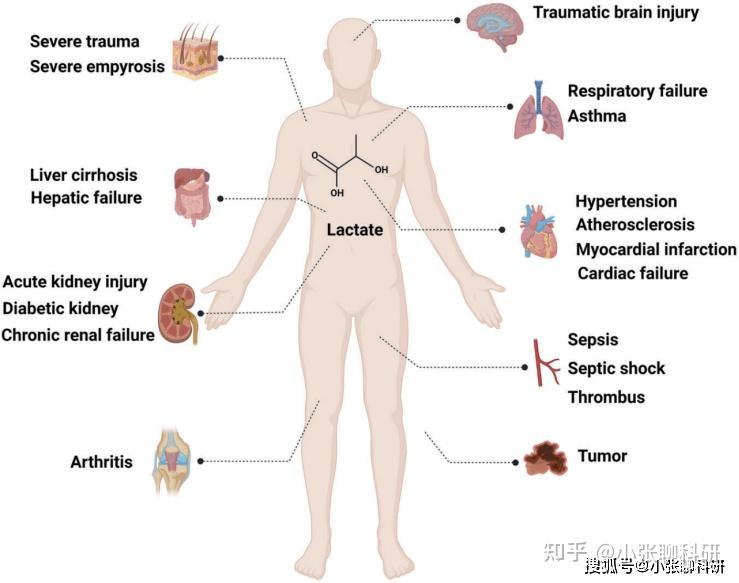
图4 乳酸在多种疾病中的调控作用
炎症响应:炎症响应涉及几乎所有器官的各种急性和慢性疾病。乳酸积累除了参与炎症损伤和免疫能量代谢外,还触发一系列调节炎症进展和肿瘤免疫耐受的细胞信号通路。
记忆形成和神经保护:在静息状态下,大脑被认为是一个乳酸净生产者。大脑中细胞产生的乳酸通过膜释放到细胞外液间隙,然后将间隙内的血管或淋巴系统引入血液,从而进入体循环。当血乳酸水平升高时,大脑变成一个吸收乳酸的净器官,血乳酸通过血脑屏障上的MCT蛋白被运输到中心。大脑细胞对乳酸的吸收增加,可以在运动中去除高达11%的身体乳酸。
伤口愈合:伤口愈合是一个动态的、复杂的生物过程。一般来说,伤口愈合可分为四个重叠的阶段,即止血、炎症、增殖和重建,这些阶段受各种细胞因子和生长因子的调节。由于分泌的细胞因子和生长因子水平较高,以及免疫系统激活时产生的新生血管导致代谢增加和可能的缺氧,乳酸在伤口愈合过程中大量代谢,并发挥着不可或缺的作用。
缺血性损伤:组织缺血破坏氧和葡萄糖的输送,导致代谢紊乱。缺氧直接导致乳酸积累,从而降低pH值来激活离子转运体[主要是Na+/H+交换蛋白(NHE)],通过将质子交换为细胞外钠离子来调节细胞内pH值。
肿瘤生长转移:毫无疑问,乳酸在促进肿瘤生长转移和微环境形成中发挥不可替代的重要作用,包括细胞增殖、侵袭、血管生成、免疫耐受和肿瘤免疫逃逸等。
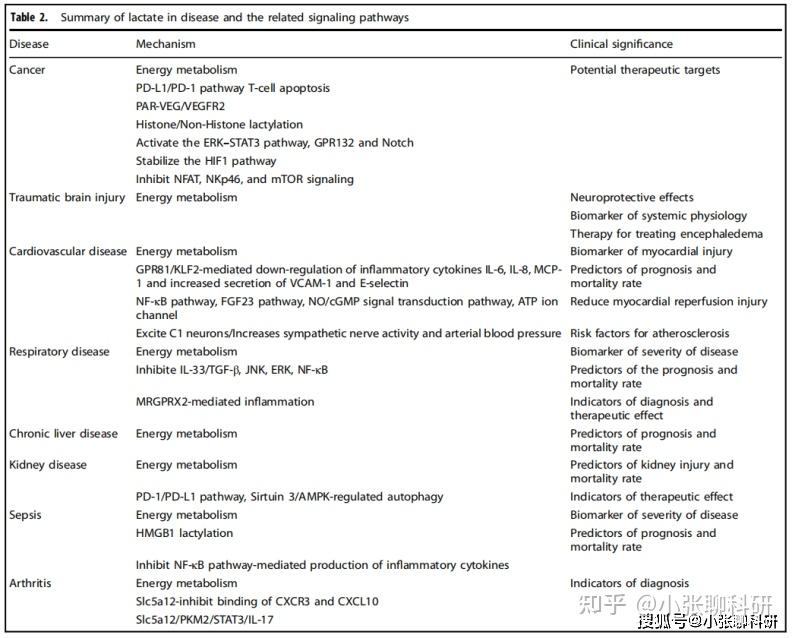
表2是乳酸在各种疾病和相关通路中功能的总结。
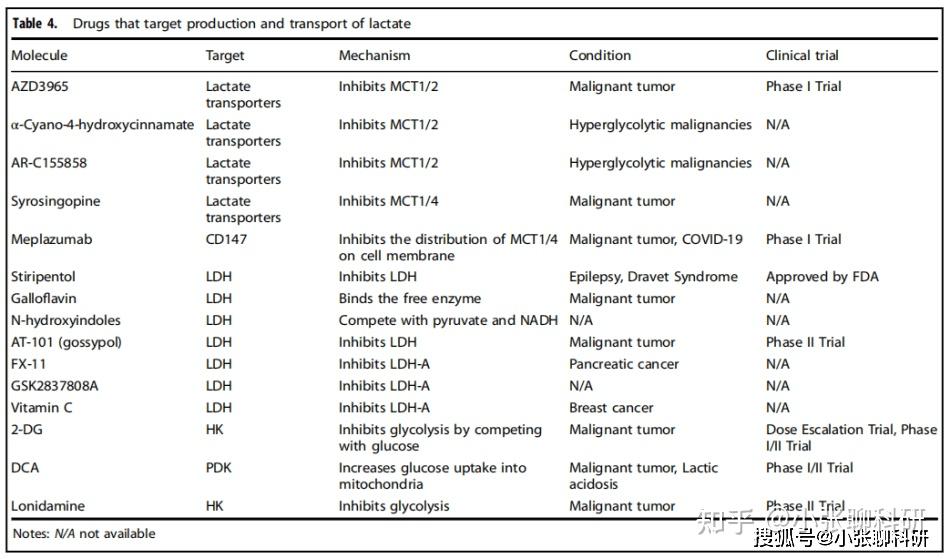
基于乳酸对肿瘤行为的重要影响,目前已开发出针对乳酸代谢的多种小分子靶向药物,具体见表4。
总结
目前已知乳酸化修饰分为非酶调控的乳酸化和酶调控的乳酸化。非酶调控的乳酸化通过糖酵解途径富集,可抑制酶活性,减少糖酵解代谢产物;而酶调控的乳糖化富集于炎症途径,可调节炎症稳态。然而这种分工是准确的描述,还是有限的相关研究导致了不准确的理解,我们对此仍然不得而知,需要更多的研究来证明。
蛋白乳酸化作为炎症、癌症和免疫抑制引起的全身疾病的治疗靶点,具有巨大的潜力。此外,乳酸化在调节神经元兴奋方面也发挥着潜在的作用,然而导致这种神经元兴奋的具体潜在机制仍未知。蛋白乳酸化及其工具酶在运动、脂肪分解、神经保护、血管生成等方面的作用和具体机制同样有待研究,这些数据将为许多慢性疾病提供新的诊断和治疗策略,如动脉粥样硬化和阿尔兹海默病。
总之,乳酸代谢和蛋白乳酸化领域无论在生命科学与医学研究还是应用方面,都具有巨大潜力,等待被更多研究者挖掘。
参考文献:
[1] Zhang, D., Tang, Z., Huang, H., Zhou, G., Cui, C., Weng, Y., Liu, W., Kim, S., Lee, S., Perez-Neut, M., Ding, J., Czyz, D., Hu, R., Ye, Z., He, M., Zheng, Y. G., Shuman, H. A., Dai, L., Ren, B., Roeder, R. G., … Zhao, Y. (2019). Metabolic regulation of gene expression by histone lactylation. Nature, 574(7779), 575–580.
[2] Liberti, M. V., & Locasale, J. W. (2020). Histone Lactylation: A New Role for Glucose Metabolism. Trends in biochemical sciences, 45(3), 179–182.
[3] Li, X., Yang, Y., Zhang, B., Lin, X., Fu, X., An, Y., Zou, Y., Wang, J. X., Wang, Z., & Yu, T. (2022). Lactate metabolism in human health and disease. Signal transduction and targeted therapy, 7(1), 305.
原文链接: |
|