|
|
01什么是组蛋白修饰
天然的DNA分子很长,尤其是在真核生物中,例如人类的DNA长度为2m(Bloom et al., 2010)。将如此庞大的遗传信息放入7μm左右的细胞核中,就需要将长DNA分子包装成更紧凑、更致密的高度压缩结构。在高中生物课上,我们知道这个结构叫做染色体,染色体是染色质高度螺旋后的形态。染色质的基本组成结构单位是核小体,因此参与核小体装配的组蛋白是决定染色质包装程度的重要因素之一。
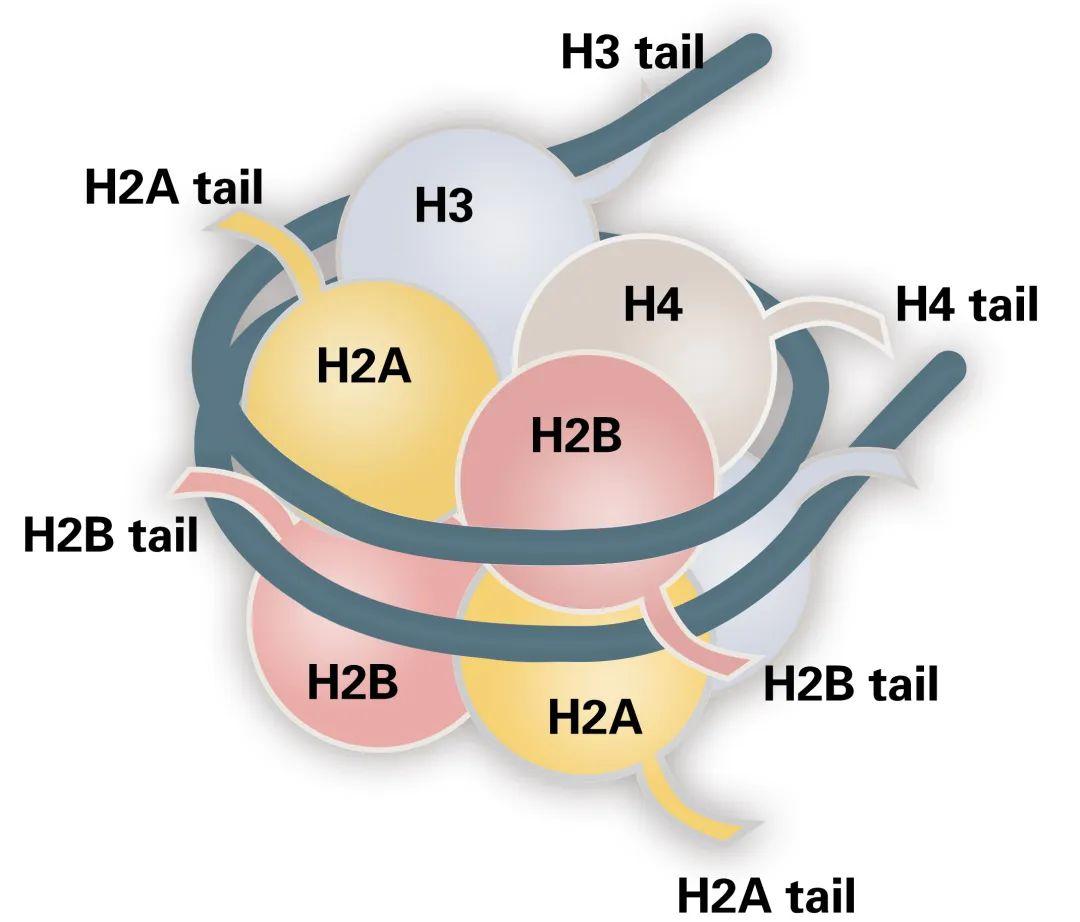
图1 核小体结构。
在先前的推文“解析表观遗传学的工具——ChIP-seq(一)”中小远详细的描述过核小体的结构和组蛋白修饰,在这里带大家再回顾一下。简单来说,核小体由H2B、H2A、H3、H4四种组蛋白(Histone)亚基各两个拷贝形成的八聚体和缠绕在外约146bp的DNA组成(图1)。其中组蛋白N端(尾部)的氨基酸残基易受到翻译后修饰(PTM),包括乙酰化、甲基化、磷酸化、泛素化等组蛋白修饰(图2)(Kouzarides et al., 2007)。近年来随着检测技术的进一步成熟,发现组蛋白的中间肽段位置以及C端也会被特异性修饰。这些修饰以不同的方式影响染色质的紧密度和可及性,从而影响基因的表达,最终影响生物各方面的生理和发育过程,是真核生物调节基因表达最重要的表观遗传调控方式之一(Lawrence et al., 2016)。
由于组蛋白修饰的类型众多,我们再回顾一下组蛋白修饰的描述规则:组蛋白结构+氨基酸名称+氨基酸位置+修饰类型。例如:H3K4ac代表H3组蛋白的第4位赖氨酸的乙酰化;H2AK119ub1代表H2A组蛋白的第199位赖氨酸的单泛素化。回顾这些知识点能够帮助大家理解后文中组蛋白修饰的具体内容,所以不要嫌伯小远啰嗦哦!
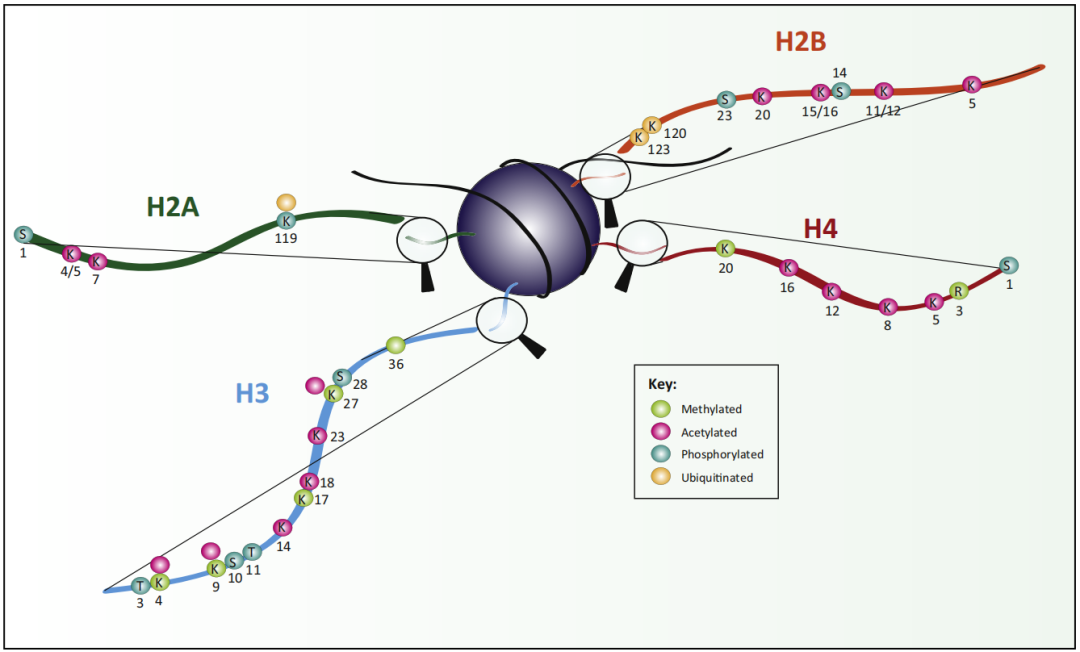
图2 显示组蛋白尾部翻译后修饰的示意图(Lawrence et al., 2016)。数字显示每个修饰的位置,字母表示每个修饰位点的氨基酸(K=赖氨酸,R=精氨酸,S=丝氨酸,T=苏氨酸)。颜色展示了每个氨基酸残基具体的修饰类型(绿色=甲基化,粉色=乙酰化,绿松石=磷酸化,米色=泛素化)。
02生命科学界的“当红明星”
组蛋白修饰是目前生命科学研究的热点。在pubmed数据库中搜索“Histone modification”可以看到该方向的文章数量逐年增加(图3)。截止至2023年3月31日,该方向的文献已达663篇。搜索“(Histone modification) AND (plant)”可以看到组蛋白修饰在植物领域的研究文献也不少(图4)。伴随着高通量测序的发展,关于组蛋白修饰在高等植物,特别是在重要农作物上的研究热度呈持续上升趋势。组蛋白修饰在植物的生长发育、重要农艺性状、抗生物胁迫、抗非生物胁迫等方面取得了一系列重要的进展(杨涛等, 2022)。对植物的组蛋白修饰进行研究是一个不错的选择,该研究对于提高植物抗性、植物表型形成机制研究、器官再生和作物改良等方面可以提供一定的理论知识和技术指导(郑月琴等, 2022)。
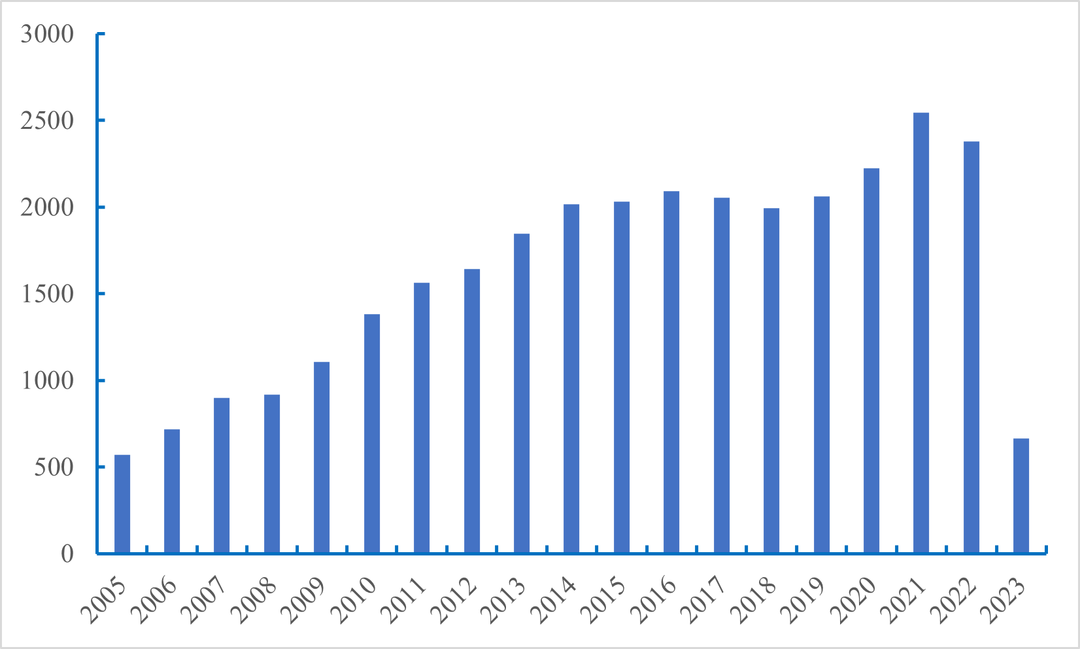
图3 从2005-2023年在pubmed数据库中搜索“Histone modification”得到的文献数量。
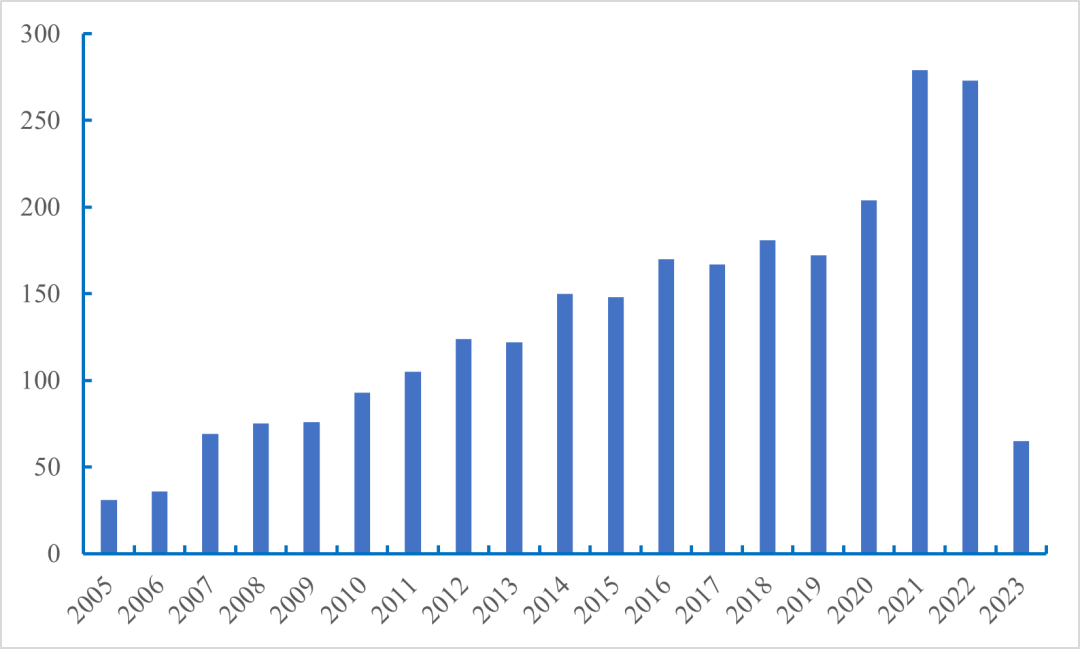
图4 从2005-2023年在pubmed数据库中搜索“(Histone modification) AND (plant)”得到的文献数量。
03组蛋白修饰与修饰酶
早在20世纪中叶,科学家们就开始对组蛋白修饰进行分析。1964年Allfrey等人提出了组蛋白乙酰化和甲基化修饰水平的升高与基因的转录激活呈正相关的假说。这一假说在此后的大量研究中得到了验证,并且还发现了其他类型的组蛋白修饰,如拟南芥转录调控中的磷酸化和泛素化(Ueda and Seki, 2020)。组蛋白乙酰化和甲基化研究最为广泛,被认为是基因表达中两种重要且普遍存在的表观遗传调控机制。
组蛋白修饰是可逆共价修饰。这种共价修饰的发生、去除以及发挥作用又主要通过组蛋白修饰酶及相应的辅因子进行调控(图5),包括Writer(写入)、Eraser(擦除)和Reader/Effector(读取)三大类(Liu et al., 2010)。Writer是催化化学基团添加到组蛋白上对其进行修饰的酶,例如:乙酰转移酶(HATs)、甲基转移酶(HMTs)、激酶和泛素酶等。Eraser是从组蛋白上去除这些修饰的酶,例如:去乙酰化酶(HDACs)、去甲基化酶(HDMs)、磷酸酶、和去泛素化酶等。Reader是识别特定翻译后修饰的底物并与之特异性结合的蛋白质或蛋白质复合物。
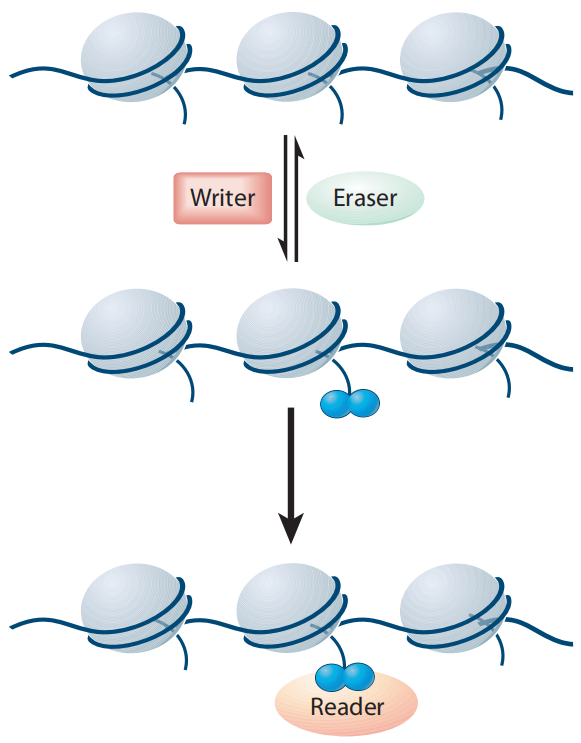
图5 Writer、Eraser和Reader/Effector联合调控组蛋白修饰的水平和类型(Liu et al., 2010)。
介绍完上面一些基础知识之后,下面小远主要给大家介绍常见的四种组蛋白修饰、部分修饰位点以及功能举例,另外还会简要介绍一些对应的组蛋白修饰酶。
3.1 组蛋白乙酰化修饰
3.1.1 组蛋白乙酰化修饰位点和功能
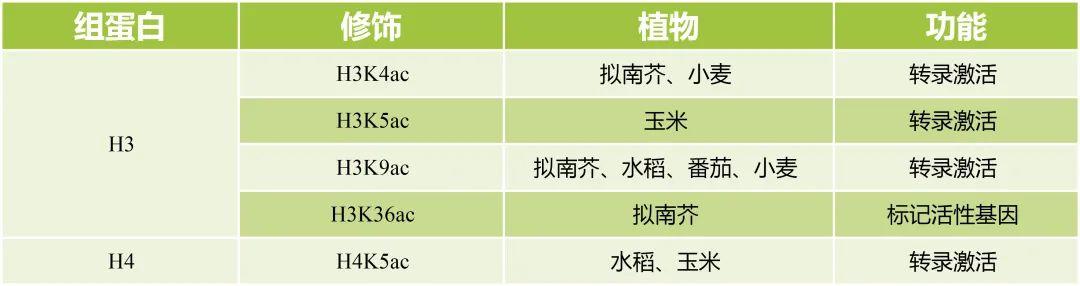
组蛋白乙酰化多发生在组蛋白H3和H4的N端赖氨酸残基上。组蛋白带正电荷,DNA带负电荷,所以组蛋白与DNA结合非常紧密。而组蛋白乙酰转移酶将乙酰辅酶A的乙酰基转移到组蛋白的赖氨酸残基上,会中和组蛋白的正电荷, 减弱DNA与组蛋白的相互作用,从而使DNA更容易与转录因子结合,因此组蛋白乙酰化往往与转录激活相关(杨涛等, 2022)。植物部分组蛋白乙酰化修饰位点和功能如表1所示,仅供参考。
表1 植物部分组蛋白乙酰化修饰位点和功能(郑月琴等, 2022)。
在医学研究中研究的最充分的是H3K27ac,H3K27ac主要位于活跃转录基因的启动子和增强子区域,在这些区域它与H3K4me3共存,一起促进基因激活表达(Creyghton et al., 2010) 。此外,H3K27ac还可在基因间区域形成超级增强子,进一步促进基因表达(Creyghton et al., 2010) 。
3.1.2 组蛋白乙酰化修饰酶
3.1.2.1 组蛋白乙酰化转移酶
组蛋白乙酰基转移酶是一个超基因家族,目前已被鉴定的组蛋白乙酰基转移酶有20多种。根据结构上的特点,植物组蛋白乙酰转移酶(Histone acetyltransferases,HATs)可分为4个家族,包括GNAT(Gcn5-related N-acetyltransferase)、MYST(MOZ-YBF2/SAS3-SAS2-TIP60)、CBP/p300(CREB-binding protein)和TAFII-250(TATA-binding protein-associated factor)4个亚家族(Lee and Workman 2007) 。不同的HATs负责催化不同的组蛋白位点:GNAT催化H3K14或H3K12位点;MYST催化H4K5位点;CBP/p300的作用位点较为广泛,对所有可以发生乙酰化的位点均有作用(夏德安等, 2015) 。GNAT是最大的组蛋白乙酰转移酶亚家族,包括GCN5、PCAF、Elp3、Hat1和Hpa2等。植物GNAT家族蛋白在N端存在长度超过100个氨基酸的保守序列(HAT结构域),C端存在一个bromodomain结构域。HATs结构域由4个motif(C、D、A和B)组成,A motif是高度保守的区域,能够与乙酰基辅酶A结合。Bromodomain结构域能够与组蛋白末端乙酰化的赖氨酸残基相结合,这种结合对于染色质结构的改变和基因表达的调节具有重要作用(Lee and Workman 2007)。
3.1.2.2 组蛋白去乙酰化酶
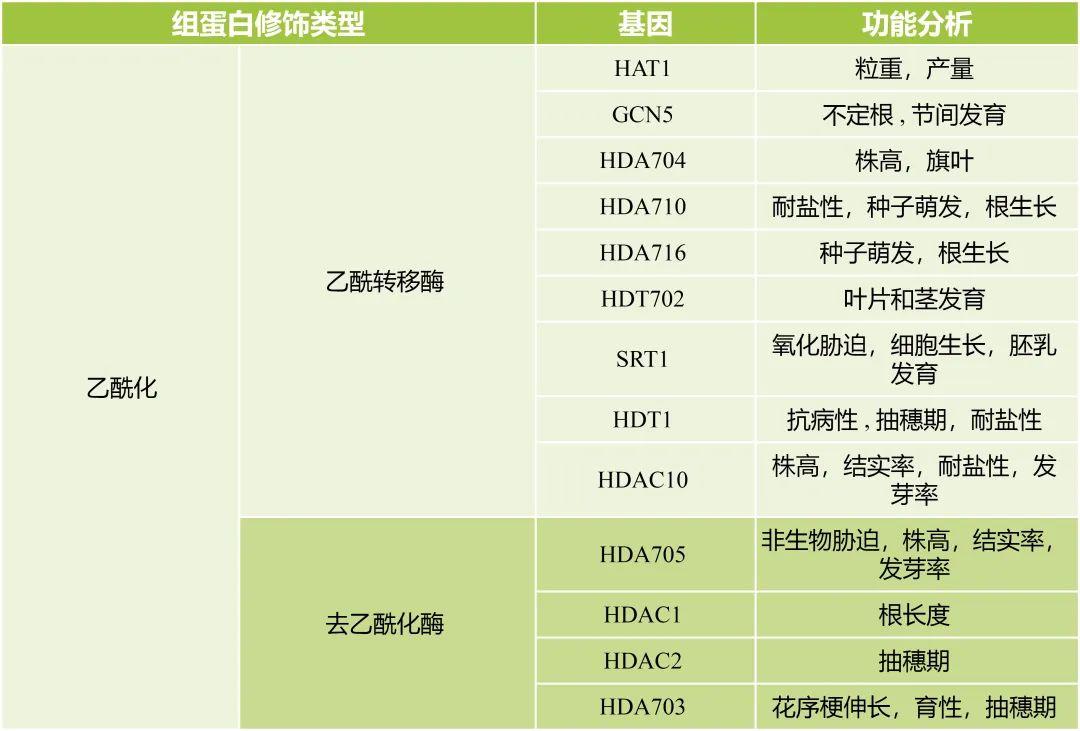
相比于组蛋白乙酰化酶,组蛋白去乙酰化酶(HDACs)的种类更多,并且数量更加庞大,目前鉴定到的HDACs可以归为3个亚家族:RPD3/HDA1、HD2和SIR2(韩召奋等, 2017) 。RPD3/HAD1在整个真核生物中普遍存在。SIR2是HDACs家族中较为特殊的一类,它与其他类型的HDACs无结构上的相似性。HD2是植物所特有的一类HDACs。水稻部分HATs和HDACs以及功能分析如表2所示,仅供参考。
表2 水稻部分HATs和HDACs以及功能分析(杨涛等, 2022)。
3.2 组蛋白甲基化修饰
3.2.1 组蛋白甲基化修饰位点和功能
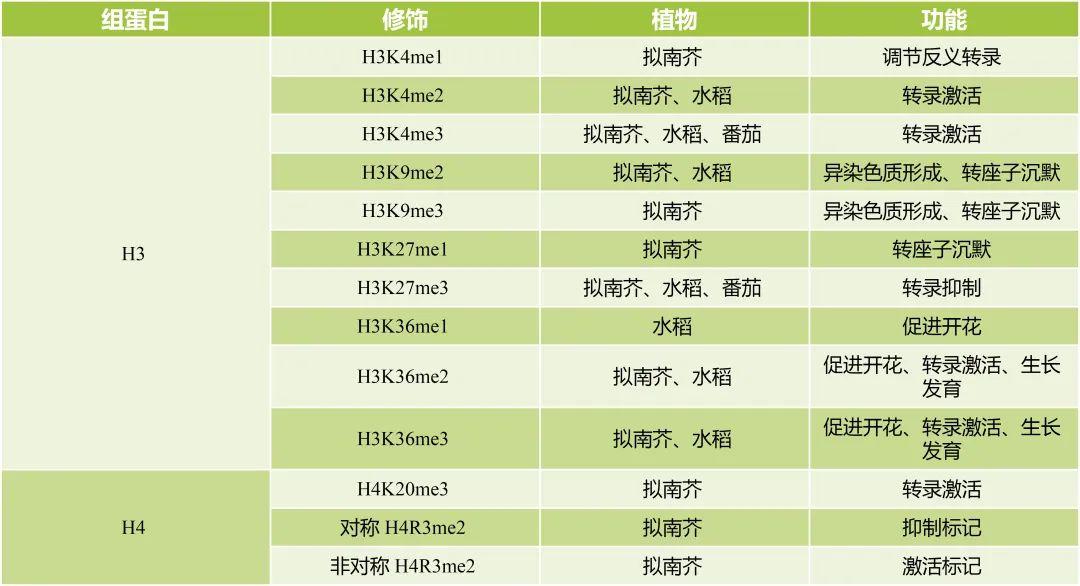
与组蛋白乙酰化不同,组蛋白甲基化不会改变组蛋白电荷,也不会直接影响组蛋白-DNA相互作用。甲基化的存在或不存在主要影响了它们与Reader蛋白的结合,导致染色质结构的改变,从而导致转录抑制或激活(Liu et al., 2010),是否抑制或激活主要取决于组蛋白中甲基化的确切氨基酸以及连接的甲基数量。组蛋白甲基化发生在赖氨酸(Lysine,K)和精氨酸(Arginine,R)残基上,赖氨酸可以分别被一、二、三甲基化(Liu et al., 2010),而精氨酸只能被一和二甲基化(二甲基化分为对称性和非对称性)。最常见的是在H3组蛋白尾部赖氨酸残基的甲基化修饰,其中,组蛋白H3第4、9、27、36位赖氨酸甲基化目前研究的最为清楚(郑月琴等, 2022)。植物部分组蛋白甲基化修饰位点和功能如表3所示,仅供参考。
表3 植物部分组蛋白甲基化修饰位点和功能(郑月琴等, 2022; Ueda and Seki 2020)。
3.2.2 组蛋白甲基化修饰酶
3.2.2.1 组蛋白甲基转移酶
组蛋白甲基转移酶(Histone methyltransferases,HMTs)将S-腺苷甲硫氨酸(Sadenosylmethionine,AdoMet/SAM)上的甲基转移到组蛋白赖氨酸或精氨酸位点上以完成对组蛋白的甲基化修饰(图4)。HMTs分为两类:赖氨酸甲基转移酶(Histone lysine methyltransferase,HKMTs)和精氨酸甲基转移酶(Protein arginine methyltrans ferases,PRMTs)(图6)(Liu et al., 2010)。
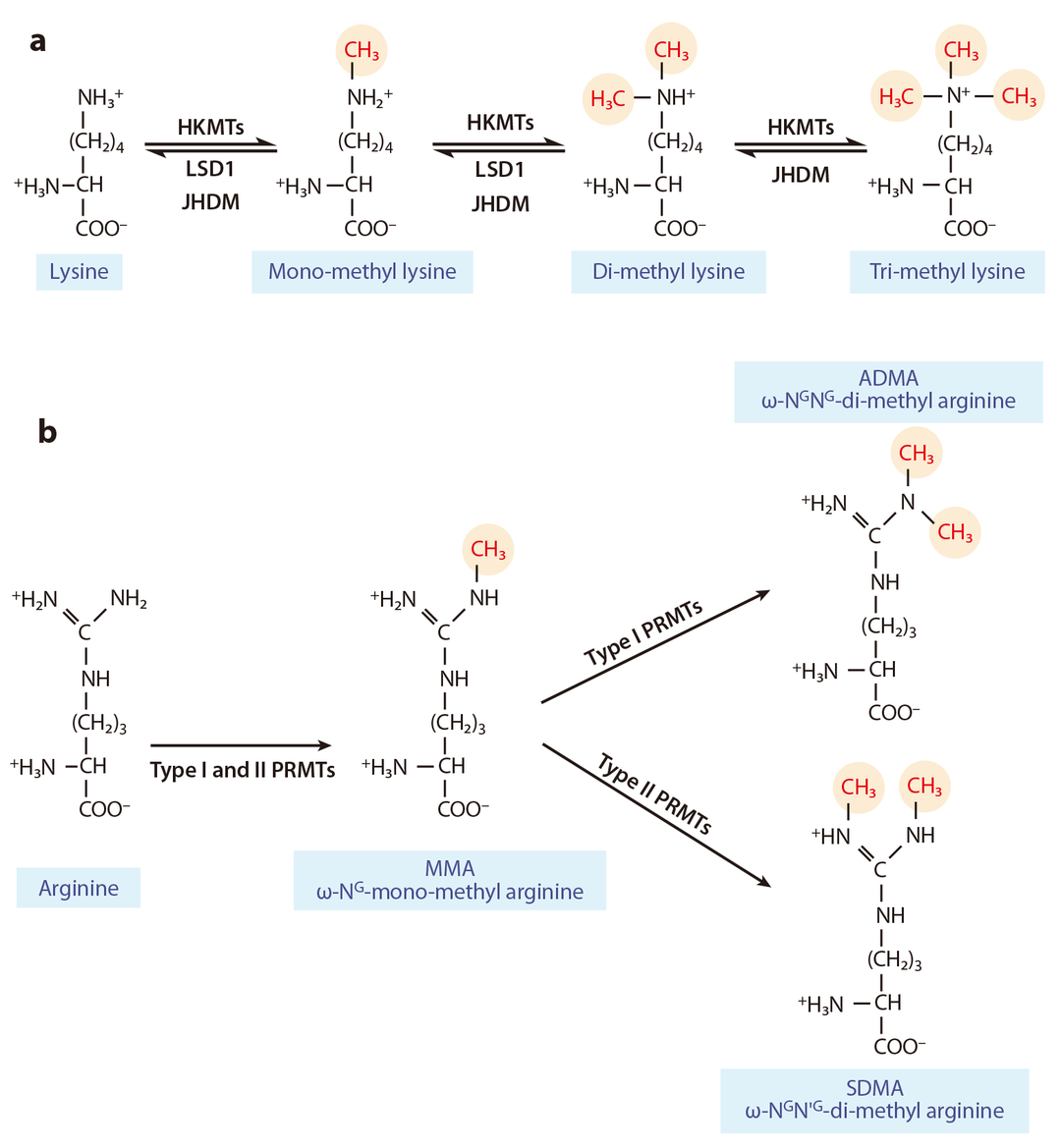
图6 赖氨酸或精氨酸残基上的组蛋白甲基化和去甲基化是一个复杂的、动态的表观遗传标记调控系统(Liu et al., 2010)。(a)一甲基化、二甲基化和三甲基化是由HKMTs和组蛋白去甲基化酶(LSD1、JHDM)催化产生;(b)I型和II型PRMT分别催化不对称和对称二甲基化。ω-NG-mono-methyl arginine,MMA:精氨酸单甲基化;ω-NGNG-di-metric methyl arginine,ADMA:非对称精氨酸二甲基化;ω-NGN’G-di-metricmethylarginine,SDMA:对称精氨酸二甲基化。
目前已知的HKMTs包含保守SET结构域(Su,enhancer of zeste,and trithorax)的SDG(SET domain group)蛋白和不含SET结构域的DOT1p(Disruptor of telomeric silencing-1p)蛋白以及DOT1L(Disruptor of telomeric silencing 1-like)蛋白。尽管这两种类型的蛋白质具有不同的甲基转移结构域,但它们都使用S-腺苷甲硫氨酸(SAM)作为甲基供体。然而迄今为止,在植物中只有SDG蛋白被认为是KMTs。植物SDG蛋白是一个很大的蛋白家族。Li Huang等人根据前人的研究将拟南芥和水稻中的SDG分为7个亚家族(Ⅰ-Ⅶ)(图7),分别为E(z)、Ash、Trx、ATXR5/6、Suv、SMYD、SETD(Zhou et al., 2020)。
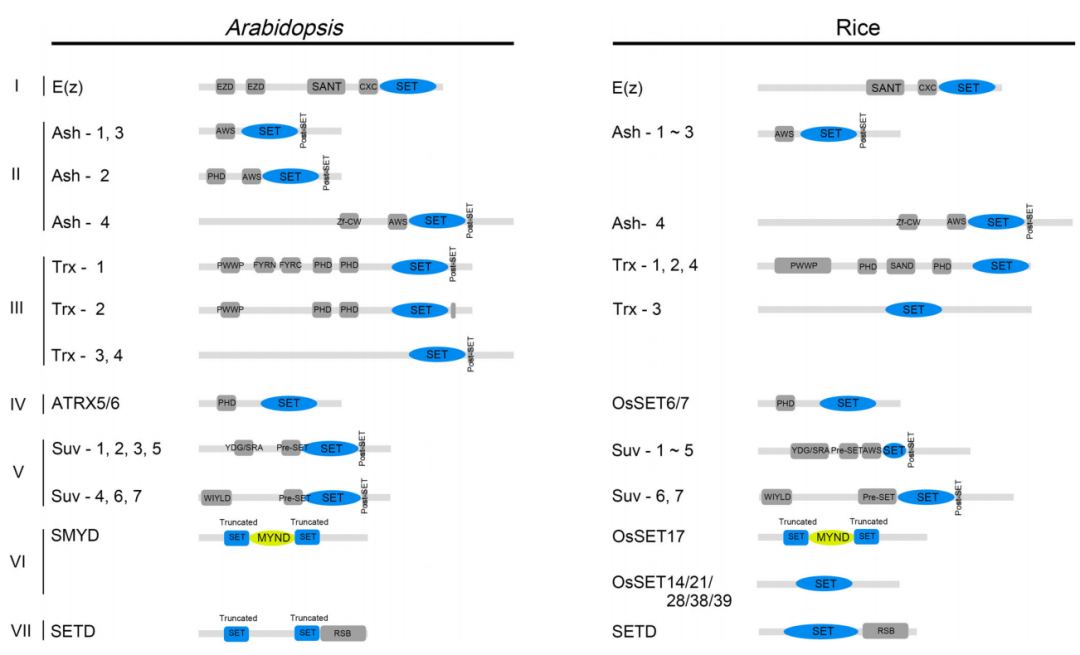
图7 拟南芥和水稻SDG蛋白的保守结构域(Zhou et al., 2020)。EZD:E(z)结构域;SANT:SWI3、ADA2、N-CoR和TFIIIB DNA结合结构域;CXC:富含半胱氨酸的区域;AWS;与SET区域关联;PHD;植物同源结构域;Zf-CW:具有保守Cys和Trp残基的锌指蛋白;PWWP:保守的Pro-Trp-Trp-Pro motif;FYRN:富含F/Y的N末端;FYRC,富含F/Y的C末端;YDG,保守的Tyr-Asp-Gly motif;SRA:一个保守的SET和一个RING锌指相关结构域;RSB、二磷酸核酮糖羧化酶(Rubisco)LSMT底物结合结构域。
PRMTs根据催化形式可以分为两类,第一类:PRMT家族中的PRMT1、PRMT2、PRMT3、PRMT4、PRMT6和PRMT8可催化形成单甲基化和非对称性二甲基化(图6)。第二类:PRMT5、PRMT7和PRMT9可催化形成单甲基化和对称性二甲基化。在已发现的酶中,除了PRMT3、PRMT8和PRMT9外,精氨酸甲基转移酶均可以作用于组蛋白(杨涛等, 2022)。PRMT家族在植物中的研究较少,在这里就不具体讨论该家族分类情况和保守结构域了。
3.2.2.2 组蛋白去甲基化酶
组蛋白去甲基化酶(Histone demethylases,HDMs)在调节组蛋白甲基化稳态中起着至关重要的作用。HDMs根据机制的不同可以分为两种:赖氨酸特异性去甲基化酶KDM1/LSD1和含有Jumonji C结构域的去甲基化酶JMJ。KDM1/LSD1通过FAD依赖的胺氧化反应对单和二甲基化的赖氨酸残基进行脱甲基化。而JMJ蛋白催化的去甲基化反应是一种依赖于铁(II)和α-酮戊二酸的双加氧酶反应,JMJ蛋白在组蛋白去甲基化中发挥重要作用,H3K4、H3K9、H3K27和H3K36甲基化修饰均可被其去除。拟南芥和水稻分别含有21和20个JmjC结构域蛋白(JMJs),Luo等人根据蛋白序列的相似性,这些JMJ被分为五个亚家族(图8B),包括:KDM5/JARID1 组、KDM4/JHDM3组、KDM3/JHDM2组、JMJD6组以及JmjC domain-only组(Luo et al., 2013)。
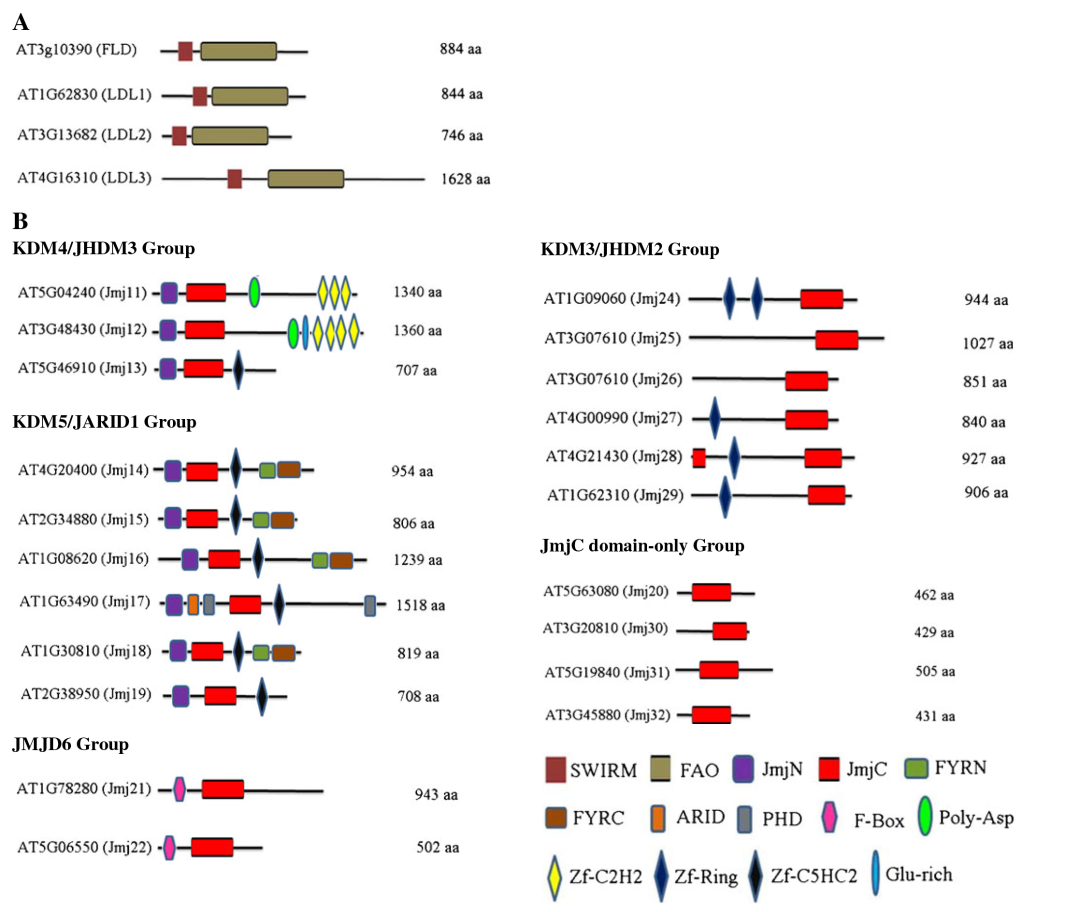
图8 拟南芥组蛋白赖氨酸去甲基化酶的保守结构域(Luo et al., 2013)。(A)KDM1/LSD1蛋白的保守结构与域;(B)JMJ家族保守结构域。
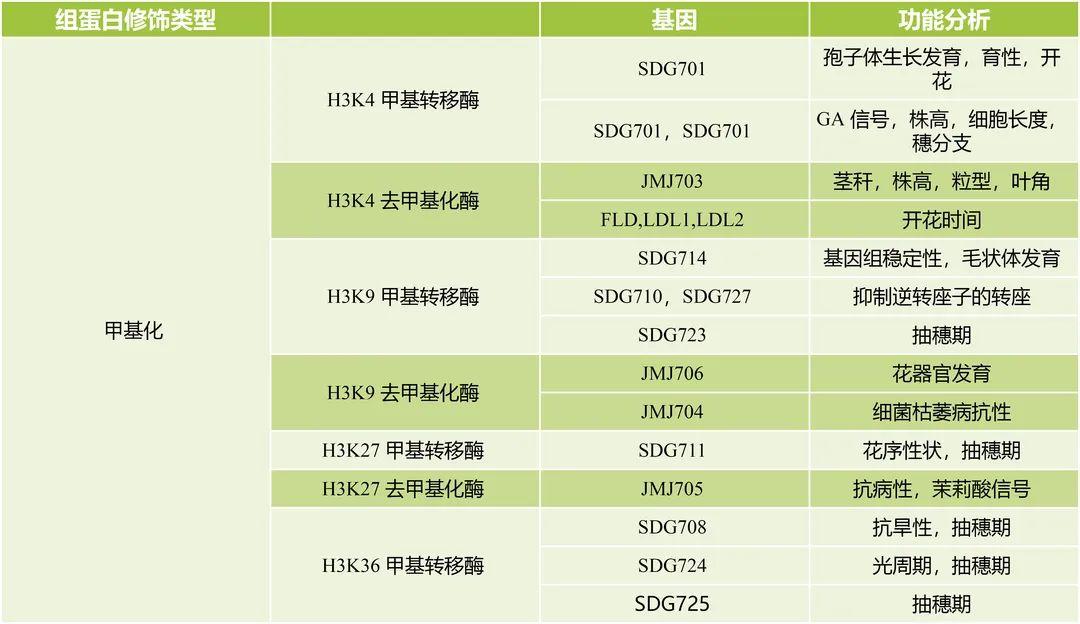
在水稻和拟南芥中HMTs和HDMs已有不少研究(杨涛等, 2022),篇幅有限,不一一列举,水稻和拟南芥部分组蛋白HMTs和HDMs以及功能分析如表4所示,仅供参考。
表4 水稻和拟南芥部分HMTs和HDMs以及功能分析 (杨涛等, 2022; Luo et al., 2013)
3.2.2.3 组蛋白甲基化的识别蛋白
甲基化组蛋白的识别(Reader)是通过具有甲基结合域的蛋白来实现的(Liu et al., 2010)。在拟南芥中,一些组蛋白甲基化识别蛋白如LHP1/TFL2、ORC1、AtING、AL和WDR5a已被证明在体内或体外结合甲基化组蛋白。
LHP1/TFL2的chromo结构域对于H3K27me3在其靶基因座的结合是必需的,并且LHP1/TFR2的结合对于H3K27me3标记基因(如开花抑制基因FLC,FLOWERING LOCUS C 1)的稳定沉默是必需的(Mylne et al., 2006)。ORC1是DNA复制起始识别复合物(ORC)的大亚基。拟南芥ORC1a和ORC1b含有在酵母和动物ORC1中不存在的PHD指状结构域。拟南芥ORC1可以通过PHD指状结构域与H3K4me3标记相互作用,这是激活靶基因转录所必需的(Sanchez et al., 2009)。
目前还不完全清楚识别蛋白是如何将组蛋白标记转化为直接的下游功能的。动物研究的一系列证据表明,一些已知的识别蛋白是具有染色质重塑或修饰活性的蛋白质复合物的亚基(Taverna et al., 2007)。
3.3 组蛋白磷酸化修饰
组蛋白磷酸化修饰影响染色体的结构和功能有两种可能的机制:第一,磷酸基团的负电荷中和了组蛋白所携带的正电荷,这造成组蛋白与DNA之间的亲和力下降;第二,磷酸化修饰有利于组蛋白与蛋白质的识别,促进蛋白质复合物的招募或者相互作用(聂文锋等, 2022)。组蛋白磷酸化通常发生在丝氨酸、苏氨酸和酪氨酸位点上,组蛋白H3的磷酸化进化保守,主要有第10位和28位的丝氨酸(H3S10p、H3S28p)以及第3位和11位的苏氨酸(H3T3p、H3T11p)。植物面对环境压力,如盐胁迫和低温胁迫,组蛋白H3磷酸化也呈现动态变化(赵琳等, 2020)。
表5 植物部分组蛋白甲基化修饰位点和功能(郑月琴等, 2022)。
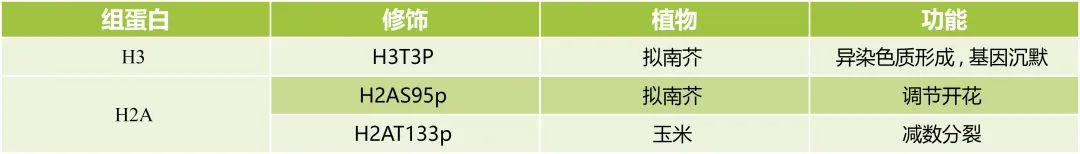
3.4 组蛋白泛素化修饰
泛素是由76个氨基酸组成的低分子量蛋白质(大约8.451 kDa),泛素化是泛素分子在激活酶、结合酶、连结酶和降解酶等一系酶的作用下,对靶蛋白进行特异性修饰的过程。组蛋白的泛素化修饰在改变染色体的构象、招募并活化下游蛋白和作为降解信号降解蛋白等方面发挥作用(聂文锋等, 2022)。目前研究最多的是组蛋白H2A和H2B的单泛素化,单泛素化的H2A多出现于异染色质中,与基因沉默有关。而单泛素化的H2B多存在于活跃的常染色质中,与转录激活有关(Lawrence et al., 2016)。
Cao等人研究表明水稻组蛋白单泛素化酶OsHUB1和OsHUB2介导的组蛋白H2B单泛素化与H3K4me2协同调控花药发育的转录调控(Cao et al., 2015)。Chen等人研究显示拟南芥E3连接酶HUB2(AtHUB2)促进组蛋白H2B单泛素化,过量表达AtHUB2能够提高转基因棉花的抗旱性(Chen et al., 2019)。
04组蛋白修饰研究方法
对于组蛋白修饰位点进行全基因组范围的研究主要有两种方法:ChIP-seq和CUT&Tag。ChIP-seq是将ChIP(染色质免疫共沉淀)和NGS(二代测序)相结合的一种方法,该方法可以通过特异性组蛋白修饰的抗体免疫沉淀来分离组蛋白的目标修饰及其结合的基因组DNA,并将相关DNA进行片段化及测序,以此来确定组蛋白修饰在基因组上的位置及丰度。该技术是研究组蛋白修饰在整个基因组中定位的金标准。大家感兴趣的话可以查看我们的往期推文“解析表观遗传学的工具——ChIP-seq(二)”
CUT&Tag是2019年开发的用于研究蛋白质与DNA之间相互作用的新方法。该方法首先通过组蛋白修饰的特异性抗体(一抗)孵育,使抗体进入细胞与靶蛋白结合。为了放大信号,使用pAG-Tn5转座体(二抗)进行孵育,使得转座体进入细胞并与抗体结合,这样就把转座体间接的固定在靶蛋白上,随后加入Mg2+,激活Tn5酶的切割活性,切断靶蛋白结合的DNA区域。由于Tn5切割DNA过程中连接有测序接头,在切断DNA的同时直接在片段化的DNA上加接头,接着提取DNA,进行PCR扩增构建文库(Zheng et al., 2020)。
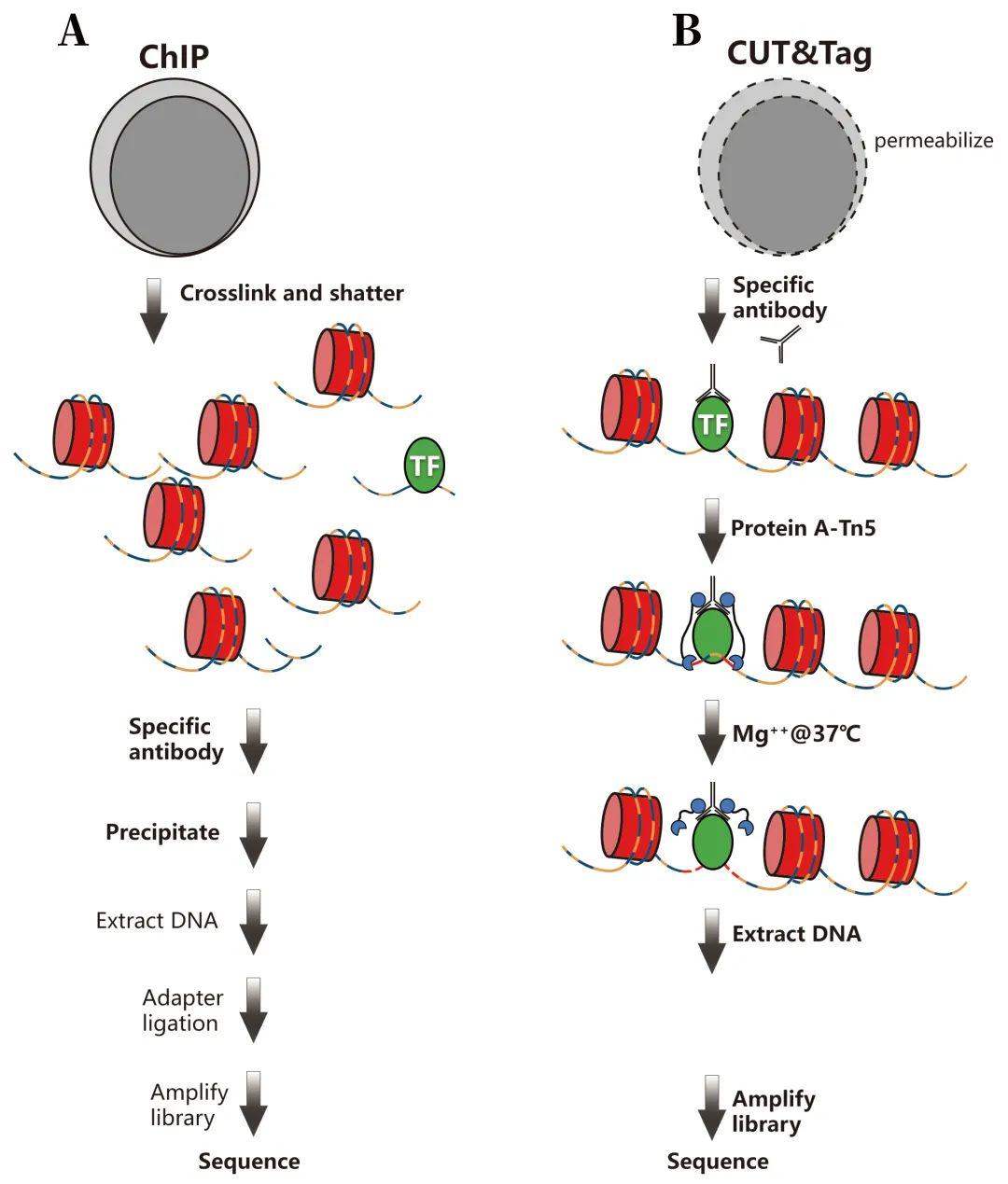
图9 ChIP-seq与CUT&Tag实验程序比较(Zheng et al., 2020)。
两种技术都是通过特异性抗体捕获所要研究的组蛋白修饰,后分离与组蛋白修饰相结合的DNA,并通过对DNA进行测序和分析来推断组蛋白修饰的位置及丰度。但相比于ChIP-Seq,CUT&Tag更有优势。CUT&Tag的优势体现在下面几点:
表6 CUT&Tag与ChIP-seq比较(Kaya-Okur et al., 2019)。

小远叨叨
小远今天主要为大家介绍了组蛋白修饰和组蛋白修饰酶,总结了部分组蛋白修饰位点和修饰酶的功能供大家参考,之前对这一块内容比较陌生的同学,刚好通过这次机会了解了解,希望能够对大家有所帮助,欢迎大家在评论区多多留言。下期还会分享组蛋白修饰在植物方面的研究应用和思路,或者是给大家介绍组蛋白修饰酶家族的研究,大家有感兴趣的内容也可以在评论区留言哦!
最后,小远想说我司拥有ChIP-seq和CUT&Tag等多组学技术,可为您研究组蛋白修饰和修饰酶提供服务,助力发表高分文章!
References:
Bloom, K. and Joglekar, A. 2010. Towards building a chromosome segregation machine. Nature 463, 446–456.
Cao H, Li X, Wang Z, et al. 2015. Histone H2B Monoubiquitination Mediated by HISTONE MONOUBIQUITINATION1 and HISTONE MONOUBIQUITINATION2 Is Involved in Anther Development by Regulating Tapetum Degradation-Related Genes in Rice. Plant Physiol 168:1389-1405.
Chen H, Feng H, Zhang X, et al. 2019. An Arabidopsis E3 ligase HUB2 increases histone H2B monoubiquitination and enhances drought tolerance in transgenic cotton. Plant Biotechnol J 17:556-568.
Creyghton MP, Cheng AW, Welstead GG, et al. 2010. Histone H3K27ac separates active from poised enhancers and predicts developmental state. Proc Natl Acad Sci U S A 107:21931-21936.
de la Paz Sanchez M, Gutierrez C. 2009. Arabidopsis ORC1 is a PHD-containing H3K4me3 effector that regulates transcription. Proc. Natl. Acad. Sci. USA 106:2065–70.
Kouzarides T. 2007. Chromatin modifications and their function. Cell 128:693-705.
Lawrence M, Daujat S, Schneider R. 2016. Lateral Thinking: How Histone Modifications Regulate Gene Expression. Trends Genet 32:42-56.
Kaya-Okur HS, Wu SJ, Codomo CA, et al. CUT&Tag for efficient epigenomic profiling of small samples and single cells. Nat Commun. 2019;10(1):1930.
Lee KK, Workman JL. 2007. Histone acetyltransferase complexes: one size doesn't fit all. Nat Rev Mol Cell Biol 8:284-295.
Liu C, Lu F, Cui X, et al. 2010. Histone methylation in higher plants. Annu Rev Plant Biol 61:395-420.
Luo M, Hung F-Y, Yang S, et al. 2013. Histone Lysine Demethylases and Their Functions in Plants. Plant Molecular Biology Reporter 32:558-565.
Mylne JS, Barrett L, Tessadori F, Mesnage S, et al. 2006. LHP1, the Arabidopsis homologue of HETEROCHROMATIN PROTEIN1, is required for epigenetic silencing of FLC. Proc. Natl. Acad.Sci. USA 103:5012–17.
Taverna SD, Li H, Ruthenburg AJ, et al. 2007. How chromatin-binding modules interpret histone modifications: lessons from professional pocket pickers. Nat Struct Mol Biol 14:1025-1040.
Ueda M, Seki M. 2020. Histone Modifications Form Epigenetic Regulatory Networks to Regulate Abiotic Stress Response. Plant Physiol 182:15-26.
Ye Zheng, Kami Ahmad, Steven Henikoff. CUT&Tag Data Processing and Analysis Tutorial. Protocol .io, 2020.
Zhou H, Liu Y, Liang Y, et al. 2020. The function of histone lysine methylation related SET domain group proteins in plants. Protein Sci 29:1120-1137.
韩召奋, 王秋苹, 罗鑫娟. 植物组蛋白去乙酰化酶的特性及功能. 中国生物化学与分子生物学报, 33(10):1008-1003.
聂文锋, 王金玉, 高春娟, 陈学好. 表观遗传修饰调控园艺植物果实发育研究进展. 园艺学报, 2022, 49 (3):671–686.
夏德安, 刘春娟, 吕世博, 马旭俊等. 植物组蛋白乙酰基转移酶的研究进展. 生物技术通报, 2015, 31(7):18-25.
杨涛, 马小倩, 张全等. 组蛋白修饰在水稻中的研究进展.中国农业科技导报, 2022, 24(4):11-20.
赵琳, 王璞, 吴琦, 宋瑞瑞等. 非生物胁迫下植物组蛋白修饰参与基因表达调控的研究进展. 生物技术通报, 2020, 36(7):182-189.
郑月琴, 王琼丽, 陈道钳等. 组蛋白修饰调控植物对胁迫的记忆与警备抗性的研究进展, 应用生态学报, 2022, 33( 3) : 844-854.
封面图像来源:https://www.whatisepigenetics.com/fundamentals/
NO.1伯远生物近期上新、优惠、招聘活动Recent promotions
【业务上新】茄子遗传转化
【业务上新】猕猴桃遗传转化
【科研绘图】伯远生物业务介绍
【优惠活动】表观组学全套技术服务8折!
【招聘简章】2023,给自己一个不一样的选择!
NO.2好文推荐Historical articles
解析表观遗传学的工具——ChIP-seq(一)
解析表观遗传学的工具——ChIP-seq(二)
解析表观遗传学的工具——ATAC-seq(一)
解析表观遗传学的工具——ATAC-seq(二)
NO.3伯远生物可以提供以下技术服务Commercial services
表观组学服务
分子生物学构建载体
二十二大植物遗传转化
各物种基因编辑全套服务
各种分子检测服务
蛋白-蛋白、蛋白-核酸相互作用筛选及验证
伯远严选试剂商城-伯远严选,为你而选!
伯远工程-让你的植物养的更安心! |
|